本帖最后由 草船借箭 于 2014-7-7 08:50 编辑
7 s9 y1 ?7 F/ J3 i3 n. J w6 P. O z2 A$ C6 P& F8 f" O7 p
 EGFR突变的非小细胞肺癌耐药机制及其克服新策略.pdf
(649.94 KB, 下载次数: 190)
EGFR突变的非小细胞肺癌耐药机制及其克服新策略.pdf
(649.94 KB, 下载次数: 190)
# N$ C6 q- S# t1 a4 [+ B
8 Y9 h! d& A4 m# r) F/ V4 j晚期非小获得性耐药后治疗
4 `4 P/ g' n; |
: w3 q: c' {0 r, u! ]' W, X3 E# |5 ?文摘:在个性化医疗时代,表皮生长因子受体(EGFR)抑制酪氨酸激酶抑制剂(TKI)一直是主要的治疗方法非小细胞肺癌(NSCLC)患者的表皮生长因子受体突变。获得性耐药,尤其是蛋氨酸的替代苏氨酸在790位置(T790M)已占超过一半的情况下,以前接受EGFR-TKI的患者出现耐药不可避免。目前,对EGFR-TKI耐药患者没有标准治疗,现已有研究或建议策略治疗这类病人。本文aimsto 重新回顾了TKI再治疗策略策略和不同代的TKI在耐药之前的的功效。
0 \( }& L l' S. a. x( ^9 \0 I( Z5 d: t- \
关键词:表皮生长因子受体(EGFR)酪氨酸激酶抑制剂(TKI); 非小细胞肺癌(NSCLC)
5 H5 o. i4 y4 V: _6 R8 }( Y4 n
& v. g( m7 X3 {# d8 `: o2 M2 _1•介绍
% M, }( ?* o6 I* ^. }" t& o肺癌是全球癌症死亡的主要原因。患者大多数诊断为非小细胞肺癌(NSCLC),通常有一个不良的预后[1、2]Iressa-Pan-Asia研究,该研究首次证明患者特点,女, 不吸烟,腺癌,比传统铂吉双重化疗在反应率(RR),无进展生存(PFS)和生活质量有更好的反应[3 - 5],表皮生长因子受体(EGFR)基因突变的发现在非小细胞肺癌的治疗策略,尤其是腺癌一个巨大的差异。EGFR外显子19缺失或外显子21 L858R突变点,是EGFR-tyrosine预测治疗的优势激酶抑制剂(EGFR-TKI)治疗[6、7]。存在EGRF突变的肿瘤因为种族的不同而不同[8]。来自西方社会约10%至15%的患者EGRF受体突变[9],约50%是亚洲人(10、11)。EGRF突变患者良好的EGFR-TKI治疗疗效有一巨大的影响非小细胞肺癌治疗的范式。因为两个亚洲研究表明超过70%的RR EGRF突变子群(5、12),一些随机前瞻性试验确认EGRF突变患者的一线EGFR-TKI,与标准铂化辽相比较有显著提高RR和PFS(13 - 15)。获得性耐药EGFR-TKI,蛋氨酸的替代苏氨酸在790位置 (T790M)点突变[16]。目前还没有标准的治疗患者EGFR-TKI。在本文中,我们回顾NSCLC患者激活EGRF突变EGFR-TKI的再治疗。
( _* W' h* S( o! I4 p2。获得EGFR-TKIs耐药
& |) g0 C# ?+ l/ }% ^1 C9 x8 q5 kEGRF突变的患者易瑞沙或特罗凯治疗最终有了耐药性PFS大约8个月, [5、12、15、19、20)。杰克曼和同事[21]为了提供一个更统一的方法在进一步的研究调查建议了使用EGFR-TKI获得性耐药之前基本定义。各种机制后来证实,关键是要弄清楚,研究一个策略来克服耐药。EGFR外显子点突变20 T790M 是第一,也是最频繁的报道的机制(17,22 - 24)。这是最初提出基于表皮生长因子受体的晶体结构酪氨酸激酶域。庞大的的蛋氨酸残留T790M ATP-binding酪氨酸激酶域口袋的变化,导致吉的或埃罗替尼被阻塞[22]。然而,它是证明最近T790M增加ATP亲和的表皮生长因子受体酪氨酸激酶域;因此,它降低了吉和埃罗替尼的绑定,因为它们是竞争ATP药物[25]。其他获得耐药机制,小部分患者发现如小细胞转换、MET扩增,上皮间叶细胞转变和PIK3CA基因突变(17日24日26日27日)。一项小型研究中韩国表现出相似的结果西方人口[24]。T790M存在确定了获得性耐药患者有一个良好的预后和无痛性进展的临床亚组。不过,三分之一的获得性耐药的机制还没有弄清楚。
9 L+ K/ D/ C& L; X临床实践中,我们通常定义的患者产生耐药性EGFR-TKI治疗三组:那些局部进展、系统性和多重进程和孤立的中枢神经的进展[31]。对于那些局部进展或孤立的中枢神经进展,建议患者治疗局部进展同时并延续EGFR-TKI治疗。缓慢进展的患者病变(s)和病灶小于预处理和进展,记录反应评估标准在实体瘤 (RECIST),没有系统性症状的恶化和/或迹象,延续的现在EGFR-TKI也建议(20,35)。因此,目前对EGFR-TKI再处理主要关注那些需要新的系统性治疗的病人,不包括那些缓慢肿瘤进展,局部转移瘤或孤立的中枢神经系统转移。
1 r+ F! Z1 V( E! f. h- ~' K0 M l: A: |2 v
3•继续或与第一代EGFR-TKIs 再处理
' R0 @; j5 g0 k几个一代EGFR-TKI已经研究了EGRF突变患者疾病进展后治疗策略。二线化疗是一个合理的选择,尽管对这个患者子群缺乏前瞻性证据。TORCH实验的亚组分析 (35、36)演示了EGFR突变埃罗替尼治疗后接受化疗,RR 15%,患者的平均四个月PFS。EGFR-TKI的中止可能导致快速肿瘤再生(37、38)和许多病人无症状或缓慢进展的病变。因此,一些肿瘤学家选择了继续TKI和延迟进一步补救化疗[28]。一些回顾性研究支持那些最初对吉非替尼有反应的患者延续吉的治疗ASPIRATION,(NCT01310026)是一个大型的前瞻性,多中心,单组实验,旨在评估在进展之余携带EGRF埃罗替尼一线治疗的疗效[41]。试验正在进行,可以给我们关于进展之余患者延续EGFR-TKI的更多的信息- K! n4 ^& U3 ]1 ?+ J5 V; ?
另外,化疗和TKI延续治疗也被认可.一个回顾性研究[42]16 NSCLC患者吉非替尼部分或完全响应,他们疾病进展后接受吉加紫杉醇。这项研究客观的RR 13%,平均PFS的4.3个月和8.1个月的总生存期(OS)。另一个回顾性研究[43]报道了相似的结果。七十八年晚期非小细胞肺癌患者携带基因突变和获得性耐药接受化疗加埃罗替尼或单独化疗。57可评价的患者的客观RR为41%化疗加埃罗替尼及18%对于那些仅接受化疗(HR = 0.31, 95%CI0.09 = 0.09;p = 0.08)。中位数PFS的病人接受化疗加埃罗替尼是4.4个月,对于那些仅接受化疗,4.2个月(p = 0.34)。值得注意的是,94%的患者在化疗加埃罗替尼组埃罗替尼作为初始TKI。在OS这两组之间没有差别。此外,小的前瞻性研究执行评估患者携带突变接受吉或埃罗替尼治疗。调查显示,疾病进展除了培美曲塞接受吉或埃罗替尼治疗,25.9%的总体RR和疾病控制率77.8%。[44]。有一个正在进行的临床试验(IMPRESS,NCT01544179)对比在一线吉非小细胞肺癌病人的进展后延续吉与添加顺铂联合培美曲塞与顺铂联合培美曲塞。5 l7 E3 m3 A. `' H5 z- a
另一个策略t进展后二线补救化疗后EGFR-TKI再使用。一个临床前模型揭示了重获TKI在非小细胞肺癌细胞的敏感性 [45]。几个小的回顾性研究发现,病人停止治疗后仍然可以EGFR-TKI敏感[46、47]。另一个回顾性研究小组(14例),经多次治疗患者从终止TKI到下个阶段接受TKI再治疗平均间隔时间为9.5个月。(3–36 months) [48]. RR是36%(n = 5)和疾病控制率为85.7%(n = 12)。在开始的再使用之前, T790M中检测出36%的病人(5╱14)。5例的2例部分的反应; 一个有稳定的疾病,和其他两个有进展的疾病[48]。在美国2012年临床肿瘤学会的会议上,一个小系列的表皮生长因子受体突变患者在停药后再使用TKI取得了有益的效果(平均时间:11个月没有TKI)。在这组经多次治疗病人4.4个月的PFS[49]。
0 @3 S/ A W) a9 i/ [ i/ u此外,I / II期临床试验, 联合西妥昔单抗,EGFR单克隆抗体和埃罗替尼是基于联合EGFR通路封锁克服获得性耐药进行假设的基础上[50]。然而, 突变的腺癌患者对埃罗替尼获得性耐药未能表现出客观的反应。 K% Z6 @* X2 J$ v; @7 d
患者EGFR突变或之前对EGFR-TKI有回应要么继续TKI结合化疗或EGFR-TKI无药间隔后再使用TKI可作为进一步的治疗策略。; e4 c0 `7 ?2 l2 k
. g4 q) ]' v) T0 o: u, I$ m; e5 }, o
4•转换为第二代EGFR-TKIs& r/ ?6 U- e: S) w/ r' b2 O% Y ]
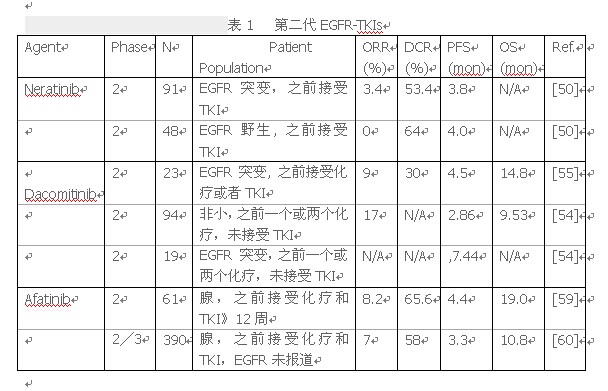
治疗期间第一代EGFR-TKIs耐药不可避免。第二代EGFR-TKIs具有理论优势。相比可逆EGFR-TKIs,不可逆转的第二代TKIs酪氨酸激酶,有更高的亲和力,它可能导致更长时间的封锁信号[51]。此外,第二代EGFR-TKIs是 pan-HER抑制剂,可能阻止表皮生长因子受体信号通路更完全。他们也有在体外对T790M突变活动。第二代EGFR-TKIs, neratinib,dacomitinib和afatinib已经得到了更多的关注最近(表1)。Neratinib(hki - 272)是一种口服,不可逆转的EGFR 和HER2抑制剂[52]。在临床前研究中,neratinib抑制的增长NCI-H1975支气管肺泡癌细胞携带替换的亮氨酸的精氨酸在858位置(L858R)和T790M细胞系携带HER2基因突变[51]。一个1期晚期实体肿瘤的研究显示的最大neratinib耐受剂量(MTD)320毫克每天一次[53]。一个开放标签,单盲,2期研究显示EGFR突变的患者曾接受吉或埃罗替尼治疗只有3%的RR超过12周。在这个子集的患者PFS中值为15.3周[54]。值得注意的是,四分之三患者 (75%)在719的位置突变甘氨酸氨基酸的替换物 (G719X)在 EGFR 获得部分反应。这四个患者中位PFS为52.7周。由于腹泻(在3/4级46%)和其他不良事件(在3/4级58%)令人难以接受,在这项研究中的剂量是每天下降到240毫克,这可能达不到治疗水平[54]。由于令人失望的结果,来那替尼neratinib目前没有被研发用于非小细胞肺癌。5 l; d1 q1 x) N g2 `* r
Dacomitinib(pf - 00299804)是HER家族一个不可逆的结合的三个酪氨酸激酶活性pan-HER抑制剂。在临床前模型,dacomitinib是高度有效地抑制HER域和抗癌活性的吉非替尼耐药细胞系和异种移植与HER2和T790M突变非小细胞肺癌模型[55,56]。一个I期晚期恶性实体瘤实验,透露了dacomitinib剂量的最大耐受剂量MTD要45毫克,每天一次[57]。在II期试验[58],非小细胞肺癌患者之前有一个或两个化疗也被包括在内。与埃罗替尼相比Dacomitinib作为第二或三线治疗。这项研究中位数PFS,与dacomitinib是2.86个月,埃罗替尼1.91个月((HR)=0.66;95%CI,0.47至0.91;双边p = 0.012)。更多的亚组分析 支持dacomitinib EGFR突变组(((HR)= 0.46;CI 95%,0.18至1.18)。在另一个二期研究[59]与66例之前处理一个或两个化疗方案和埃罗替尼,dacomitinib证明腺癌患者5%客观RR 。总体PFS中位数为12周,EGFR突变患者18周。胃肠道和皮肤病学的不良事件,主要是1到2级, dacomitinib组比埃罗替尼更常见的(58,59)。基于上述数据,随机,双盲,第三阶段研究(1009;NCT01360554)比较dacomitinib与埃罗替尼,晚期非小细胞肺癌患者之前至少有一个治疗。然而,相比埃罗替尼它未能实现目标,展示显著改善PFS。BR•26实验,双盲,安慰剂对照,随机研究比较dacomitinib和安慰剂在晚期非小细胞肺癌患者标准治疗化疗和EGFR-TKI后,还未能实现其目标延长OS。另一个临床试验(ARCHER1050;NCT01774721)比较dacomitinib与吉非替尼在晚期非小细胞肺癌EGFR突变在也正在进行。
6 J% C" y% K0 q0 A
$ d2 d$ I1 [3 ~ O: y# ]
 & S* B) m$ d. F( d, |2 W
& S* B) m$ d. F( d, |2 W
8 P# |* [: \$ [1 k; z
- K/ `0 X: Q8 J0 b
( q3 z( r( k9 r6 Z1 B' ^
Afatinib(BIBW 2992)是一个具有高度选择性的,不可逆转的表皮生长因子受体抑制剂和pan-HER抑制剂[60]。在体外和体内的临床前模型,afatinib证明增加常见的EGFR突变以及T790M突变亲和力[60]。经过几期研究(61、62),MTD在每日50毫克口服确立,LUX-Lung系列试验显示出不错的效果。首先,单臂,二期试验(LUX-Lung 4),包括日本肺腺癌患者进展≥12周,之前接受过吉和/或埃罗替尼,在第三或第四线显示适度的影响[63]。大部分患者(72.6%) ,EGFR突变阳性,95.2%的所有患者EGFR-TKI至少24周。中止前EGFR-TKI和afatinib开始,之间的平均时间间隔三周(从2到13周);83.9%的患者(62例中52)的间隔不到四个星期。afatinib开始前52名患者有一个化疗和10位病人有两个。客观的RR为8.2%(61中5个可评价的患者,95% CI,2.7%到18.1%),和疾病控制率为65.6%( 61中40可评价的患者中,95% CI,52.3%到77.3%)。主要的不良事件是腹泻(100%)和皮疹/粉刺(91.9%)所有等级。第二,IIb阶段/ III随机试验(LUX-lung 1) 585非小细胞肺癌患者疾病进展前一个或两个化疗方案和吉/埃罗替尼[64]评估afatinib加上最好支持性治疗(BSC)与安慰剂加最好支持性治疗,afatinib组客观的反应是7%(585例中29)。PFS中值afatinib组为3.3个月(95% CI,2.79 - -4.40),另一个组1.1个月组(95% CI,0.95 - -1.68)的HR 0.38 (95% CI,0.31 - -0.48;p < 0.0001)。亚组分析更支持afatinib用于EGFR 突变阳性患者,HR为0.51(95% CI,0.31 - -0.85)。然而,这项研究并没有满足其主要终点,afatinib和安慰剂OS中值分别为10.8个月对12.0个月(HR = 1.08;95%CI:0.86 - -1.35)。腹泻(87%)和皮疹/粉刺(78%)是最常报告的不良事件。像吉非替尼,Afatinib进一步评估与化疗相结合,多中心,III期随机研究(LUX-lung 5)。LUX-lung 5(NCT01085136)会比较afatinib加紫杉醇化疗与调查员的选择仅在非小细胞肺癌患者之前有吉非替尼或埃罗替尼治疗失败患者,随后afatinib单药治疗后化疗比对。初步结果将2014年ASCO年会上报道。一线Afatinib也与标准化疗比对(65、66)。第三, afatinib和西妥昔单抗的结合有最新进展。异种移植物模型的小鼠, 与吉加西妥昔单抗相比,西妥昔单抗和afatinib会导致埃罗替尼肿瘤耐药基因T790M显著减少[67]。二期的一项研究支持上面的临床前数据,然后进行使用西妥昔单抗和afatinib在非小细胞肺癌患者第一代EGFR-TKIs获得性耐药临床(68、69)。有确认部分反应的报道,22位患者中8位(36%,95%置信区间:0.17—-0.59),包括4/13的患者(29%)T790M突变阳性。中位数PFS是4.7个月。; E* N1 ^+ s- U; R1 L7 U _
; v1 `3 g3 _. v7 Q) g' E
5•第三代EGFR-TKIs
& u& n7 L& Q _5 }: W9 P" |$ d$ ]2 [8 Y: f8 g1 ~! j; T& W& i/ L/ s
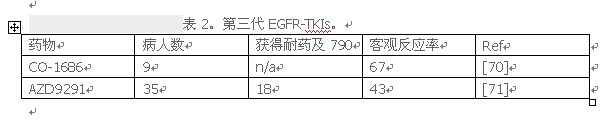
第二代EGFR-TKIs,比如dacomitinib afatinib,在临床前模型取得了可喜的效果,由于其毒性,在之前有EGFR-TKIs而获得性耐药患者,限制了其的使用。一种针对T790M新的TKIs正在研发之中。其中,co - 1686和AZD9291第三代EGFR-TKIs目前在早期临床发展现状,有一些临床数据(表2)。
; ^) D: `$ @( C" Y. r. q; e! U O. H" N+ K
 3 ]1 Y, q, [: X& T! }
3 ]1 Y, q, [: X& T! }
: G7 P( C* M) t, c
+ ?& `$ Y7 H8 ]' T- [CO- 1686、2, 4-disubstituted嘧啶化合物,是一种新型、口服非小细胞肺癌EGFR抑制剂。它既不可逆转和选择性,它可以抑制体内和体外EGRF突变,特别是在T790M突变[70]。在临床前模型,证明了在人类抗肿瘤活性EGFRL858R和EGFRL858R / T79°M-expressing转基因小鼠。活动在EGFR野生型的无受体信号[70]。在2014年ELCC 会议[72],报道co - 1686 I / II期研究EGRF突变患者疾病进展之前EGFR-TKI。总共62名患者入组,剂量范围从150 mg到900 mg 每天 自由基础配方和500 mg 到 1000 mg 每天 氢溴酸盐(HBr)盐配方。约百分之七十五的人都是TKI TKI耐药直接进展。CO- 1686是耐受性良好,只有一个病人由于副反应中断。20%以上的患者发现治疗相关的不良事件。三级高血糖(19%)被报道,但通常无症状。QTc延长三级5%的病例观察到,大部分剂量减少后解决。其他副作用,如恶心、腹泻、食欲下降和疲劳,> 10%的患者被发现,但主要是在1级。剂量相关性野生型腹泻和皮疹还没有见过。基于有希望的结果,一些临床试验计划今年评估不同临床设置CO- 1686的功效。
3 y2 b* ^- P. D/ o: Y* z6 N8 R
/ g) h5 G/ U! h, UAZD9291是一个强大的、不可逆转的和有效的抑制剂,在体外敏化EGFR突变和耐药突变细胞系,EGFR野生型除外[71]。药物展示抗肿瘤活动在低剂量水平EGFR-mutant 异种移植[71]。1期开放标签、多中心试验已经进行,针对疾病进展之前EGFR-TKI疗法的晚期非小细胞肺癌患者。在实验中AZD9291耐受性良好,没有剂量限制性毒性,剂量20,80或160毫克/天。初步数据显示[73],35中15名患者已确认和不确认部分反应(43%),其中包括18名患者中9名阳性T790M。其中一个,T790M阴性,也有部分反应。co - 1686和AZD9291成功的结果治疗可能对晚期的EGRF突变的肺癌治疗产生巨大大的影响他们都表现活跃在敏化EGRF突变,以及耐药基因突变。第三代EGFR-TKIs进一步临床试验将揭示抗肿瘤活动。* H( q% B0 H) t% w# a; t
5 D- h% y& k' B, {+ @: R$ s
& j: l: [: l; @1 C# A) w& M, z
|